 La terapia celular ha proporcionado resultados prometedores para el tratamiento de las enfermedades cardiovasculares. De hecho, está en curso un gran número de ensayos clínicos cuyo objetivo es lograr la revascularización, la resincronización, la recuperación funcional y la regeneración del miocardio, así como una disminución del remodelado ventricular.
La terapia celular ha proporcionado resultados prometedores para el tratamiento de las enfermedades cardiovasculares. De hecho, está en curso un gran número de ensayos clínicos cuyo objetivo es lograr la revascularización, la resincronización, la recuperación funcional y la regeneración del miocardio, así como una disminución del remodelado ventricular. Resultados de los primeros ensayos clínicos1-4 indican que las células progenitoras y las células madre procedentes de la médula ósea autóloga pueden mejorar la función miocárdica cuando son administradas mediante inyección intracoronaria.
Esto ha proporcionado un gran impulso para la investigación de la terapia celular en el tratamiento de las cardiopatías. Quizá la pregunta más importante que se plantea desde el punto de vista de la investigación básica sería: «¿qué mecanismos utilizan las terapias celulares para mejorar la función cardiovascular?».
Los mecanismos propuestos incluyen la neovascularización (directamente o mediante la liberación de factores de crecimiento), la activación de la protección celular a través de la liberación de factores paracrinos, la movilización y activación de las células madre residentes, la supresión de la inflamación, y la diferenciación muscular5.
Tan importante es aclarar los mecanismos de funcionamiento de la terapia celular como identificar los tipos de célula más eficaces, evaluar la seguridad de la terapia, comprender sus beneficios a largo plazo, averiguar la mejor forma de aplicarla, mejorar la funcionalidad del injerto celular y la supervivencia de las células y determinar la mejor forma de rastrear el destino de la terapia celular in vivo con el paso del tiempo. 

Las técnicas de imagen no invasiva pueden tener un papel importante en los estudios diseñados para responder a muchas de estas cuestiones.
La ecocardiografía, la resonancia magnética (RM), la tomografía computarizada (TC), la tomografía por emisión de positrones (PET) y la tomografía computarizada por emisión de fotón único (SPECT) ya se utilizan en la clínica para evaluar la función, la viabilidad, la perfusión y la anatomía del miocardio.
La incorporación de técnicas de imagen a los experimentos de investigación básica sobre terapia celular cuenta con importantes ventajas. En principio, permite explorar in vivo los efectos terapéuticos en la anatomía y la fisiología, al tiempo que reduce el número de animales requeridos para llevar a cabo los experimentos.
Además, permiten evaluar de forma seriada la progresión de la enfermedad y la respuesta al tratamiento y, frecuentemente, realizar mediciones cuantitativas más precisas o incluso determinaciones que serían imposibles empleando otros métodos.
El propósito de este artículo es revisar las distintas modalidades de imagen cardiovascular no invasiva en el contexto de las terapias celulares. Para cada modalidad se aporta una breve descripción de la tecnología utilizada, junto con ejemplos de su utilización para evaluar la eficacia de la terapia celular y las estrategias terapéuticas. 

ECOCARDIOGRAFÍA
La ecografía o ultrasonografía cardiaca es un método ampliamente utilizado en las clínicas cardiológicas de todo el mundo para evaluar la función y el tamaño cardiacos, la función valvular y la afección del pericardio.
El principio general que subyace a la obtención de imágenes por ultrasonidos es que un transductor piezoeléctrico convierte las señales eléctricas en ondas acústicas que oscilan con una frecuencia de 2 a 30 MHz.
Estas ondas acústicas se transmiten al interior del organismo y se reflejan a medida que pasan a través de las distintas capas de tejidos.
A su vez, las ondas acústicas reflejadas hacen vibrar el transductor que las generó. Estas vibraciones se convierten de nuevo en señales eléctricas y se envían al escáner para el procesamiento de imágenes.
Los datos sobre la duración del eco, la frecuencia y la intensidad de la señal se utilizan para generar la imagen ultrasónica. Es importante destacar que la magnitud de la frecuencia de excitación es directamente proporcional a l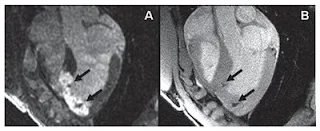 a profundidad de penetración de la onda acústica y la resolución espacial de la imagen.
a profundidad de penetración de la onda acústica y la resolución espacial de la imagen.
 a profundidad de penetración de la onda acústica y la resolución espacial de la imagen.
a profundidad de penetración de la onda acústica y la resolución espacial de la imagen. La ecografía Doppler puede medir el flujo y su velocidad relativa.
La ecocardiografía de contraste utiliza microburbujas rellenas de gas para realzar las superficies de contacto sangremiocardio y mejorar la determinación de la perfusión tisular y el flujo sanguíneo6. Recientemente se ha avanzado hacia la conjugación de microburbujas con ligandos marcados que se unen a receptores y permitirían la aplicación dirigida de agentes de contraste en las zonas afectas7.
La ecocardiografía se ha utilizado principalmente para investigar los cambios funcionales que se dan tras el trasplante de células. Jin et al8 utilizaron la ultrasonografía cardiaca para mostrar que la fracción de eyección ventricular izquierda aumentaba de forma significativa en ratas postinfarto receptoras de células madre mesenquimatosas (MSC) trasplantadas en el interior de un armazón biodegradable.
Wolf et al9 utilizaron ultrasonidos convencionales en modo B y ecocardiografía de contraste para evaluar el tratamiento intravenoso con MSC propias y alogénicas en cerdos infartados. En este estudio, la ecografía de contraste del miocardio evidenció zonas de infarto más pequeñas y una mejora del flujo microvascular en las zonas del borde del tejido isquémico de los animales tratados.
La ecocardiografía convencional puso de manifiesto un mayor acortamiento del área fraccional y una mejor sincronía cardiaca.
Diversos investigadores han comenzado también a explorar técnicas para administrar y rastrear las células mediante ultrasonidos. Bara et al10 marcaron células CD133+ humanas con nanopartículas CliniMACS y utilizaron con éxito la ecocardiografía para seguir la administración y el destino de dichas células en un modelo porcino de infarto de miocardio (fig. 1)11.
Asimismo, otros grupos han utilizado con éxito microburbujas con ultrasonidos para dirigir el trasplante de MSC y de células progenitoras endoteliales hacia el miocardio infartado12,13.
Fig. 1. Imágenes ecocardiográficas del ápex posterolateral antes (A) y después (B) de conseguir la funcionalidad de células CD133+ injertadas y marcadas magnéticamente con CliniMACs. Las células marcadas magnéticamente aparecen hiperecoicas (flechas verdes) en imágenes tomadas tras la administración. Adaptado con autorización de Ruhparwar et al11.
RESONANCIA MAGNÉTICALa RM es una modalidad de obtención de imágenes multipropósito cuya versatilidad es especialmente evidente en la obtención de imágenes cardiovasculares. Se utiliza con frecuencia para evaluar la anatomía cardiaca, la función ventricular, la masa miocárdica, la viabilidad miocárdica, el flujo sanguíneo, la perfusión e incluso la energía en el miocardio.
De forma sencilla, la RM realiza aplicando un potente campo magnético homogéneo para alinear la magnetización nuclear de los átomos de hidrógeno o protones del agua en el organismo. Se utilizan pulsos de radiofrecuencia para excitar la magnetización, lo que conduce a la generación de una señal.
Se emplea un grupo de bobinas ortogonales de gradiente para alterar el campo magnético de forma sistemática y para obtener la codificación espacial de la magnetización, lo que puede usarse para generar la imagen.
Modificando los tiempos y el orden de la secuencia de activaciones de los pulsos de radiofrecuencia y gradiente, junto con la abundancia natural y las propiedades de relajación (T1 y T2) de los spines nucleares de los diferentes tipos de tejido, pueden generarse imágenes de RM de diverso tipo y con diferentes contrastes.
El caballo de batalla de la RM es la cine-RM convencional, que se usa principalmente para evaluar la anatomía cardiaca y la función general.
El análisis regional de parámetros, como el espesor de la pared, puede evaluarse mediante métodos tales como el modelo de 17 segmentos de la American Heart Association (AHA)14. Muchos estudios han empleado, tras la aplicación de la terapia celular, la cine-RM para evaluar los cambios en la función y el remodelado miocárdicos tras un infarto15-20.
Por ejemplo, Grauss et al18 han demostrado recientemente que la función ventricular izquierda (VI) mejoró y que el remodelado ventricular disminuyó en ratones postinfarto que recibieron MSC humanas forzadas a expresar el factor de transcripción cardiomiogénico miocardina.
Hashemi et al19 usaron la cine-RM en un estudio de determinación de dosis controlado con placebo para evaluar la seguridad de la administración endomiocárdica de MSC alogénicas en cerdos postinfarto.
Para poner de manifiesto los cambios regionales más sutiles en la función contráctil, incluida la diferenciación entre los cambios subendocárdicos y transmurales, se han aplicado técnicas como la marcación miocárdica21,22, la obtención de imágenes codificadas del desplazamiento23,24 e imágenes de fase armónica25 en modelos animales de enfermedad cardiovascular.
En un artículo de revisión publicado por Epstein26, se puede encontrar más detalles sobre estas técnicas.
Al disponer de mayor resolución para determinar la función contráctil, se han llevado a cabo estudios, como el de Amado et al27, que han permitido identificar la recuperación en función del tiempo de la contractilidad local asociada a la aparición de nuevo tejido como resultado del trasplante de MSC alogénicas en un modelo de infarto de miocardio en cerdos.
La RM con realce tardío (RT) con gadolinio se ha validado frente a la tinción histológica como un método preciso y no invasivo para determinar el tamaño del infarto28,29.
Por su naturaleza, muchos estudios de investigación básica sobre el infarto de miocardio han usado la RM-RT para comparar el tamaño del infarto entre distintos grupos, así como durante el periodo de estudio15.
La RM-RT comprende la administración intravenosa de un medio de contraste paramagnético (p. ej., Gd-DTPA), un tiempo de espera de 10-15 min aproximadamente para que el medio de contraste se «concentre» en el tejido infartado y se «elimine» del miocardio normal, y la obtención de imágenes usando una secuencia de RM diseñada para anular la señal en el miocardio normal y realzar el miocardio infartado, donde el medio de contraste se acumula temporalmente.
En la figura 2A se presenta un ejemplo de RM-RT que muestra el miocardio infartado claramente delineado30.
Fig. 2. Resonancia magnética (RM) retardada con contraste realzado en el eje largo (A) y RM ponderada con gradiente de eco en T2* (B) de células madre mesenquimatosas marcadas para-magnéticamente en las 24 h posteriores a la inyección intramiocárdica.
Se observaron dos lugares de inyección de las células marcadas con óxido de hierro como lesiones hipointensas (flechas) en la RM con gradiente de eco de alta resolución. Estos lugares de inyección también se observan en la RM retardada con contraste realzado, y se localizan con claridad en el miocardio infartado. Adaptado de Kraitchman et al30.
La obtención de imágenes de RM dinámica de primer paso puede aplicarse de forma complementaria a la RM-RT como medio para medir la perfusión miocárdica.
La perfusión del miocardio puede evaluarse cualitativa y cuantitativamente utilizando secuencias de imágenes de RM dedicada, fuertemente ponderada en T1 y sensible a la perfusión durante la infusión inicial de medios de contraste con gadolinio31.
Un reciente estudio de Schuleri et al32 demostró mediante RM con perfusión de primer paso, en cerdos postinfarto tratados con inyecciones intramiocárdicas de MSC alogénicas, que hay un aumento temprano de la perfusión miocárdica que precede a un aumento posterior de la función contráctil, así como una reducción de la apoptosis.
Dichos resultados podrían proporcionar información importante sobre el mecanismo por el cual actúa la terapia celular para tratar la enfermedad.
Aunque generalmente no se la considera una técnica de obtención de imágenes, la espectroscopia por RM es una técnica análoga a la RM. La espectroscopia por RM permite analizar los cambios energéticos en el miocardio y puede utilizarse con el mismo equipo de obtención de imágenes. Zeng et al33 observaron, mediante espectroscopia por RM con 31P, que es posible mejorar significativamente la bioenergética postinfarto en el corazón de cerdo (determinada por el índice subendocárdico fosfocreatina/adenosintrifosfato) trasplantando células progenitoras pluripotenciales de médula ósea en zonas fronterizas de miocardio.
Además, pudieron demostrar que dicha mejoría en la bioenergética estaba respaldada por mejoras de la contractilidad regional y general determinada por cine-RM. Se han comunicado resultados similares mediante trasplante de MSC autólogas34.
La evaluación de la respuesta anatómica y fisiológica a la terapia celular es tan importante como confirmar la funcionalidad del injerto y estudiar el destino de las células. Las nanopartículas de óxido de hierro se han utilizado ampliamente para marcar y seguir las células con RM in vivo35,36. Sus propiedades superparamagnéticas, cuando las partículas pasan al interior celular, hacen que se pueda ver dichas células como hipointensidades en las imágenes convencionales de RM.
La obtención de imágenes ponderadas en T2* es el método más habitual para visualizar estos grupos celulares hipointensos. Los estudios sobre toxicidad han confirmado que dicha marcación con óxido de hierro no tiene ningún o casi ningún efecto negativo en el metabolismo o la viabilidad celular35,37. Se han realizado numerosos estudios con nanopartículas de óxido de hierro para marcar las células antes del trasplante30,38,39.
Uno de los primeros estudios realizados en cerdos postinfarto demostró que podían visualizarse con claridad las MSC marcadas con hierro inmediatamente después del trasplante y en tiempos establecidos hasta varias semanas más tarde (fig. 2B)30. Recientemente la imagen con contraste positivo ha cobrado interés como un posible método para mejorar la visualización y la sensibilidad40-42.
Al obtener una imagen clara de la anatomía cardiaca y una representación del tejido infartado, además de la visualización de la terapia con células marcadas, la RM aporta un amplio espectro de herramientas para evaluar la eficacia y el injerto/destino de las células. Como parte del equipo de diagnóstico, la fluoroscopia por RM se ha utilizado para que las terapias celulares sirvieran de guía en tiempo real en sus ubicaciones diana como el tejido infartado y sus zonas fronterizas43-47.
Esta capacidad permite la administración más precisa y concentrada de las terapias celulares en el tejido enfermo que con los métodos intravenosos o intraarteriales y promete ser un método más eficaz para la administración de la terapia. Sin embargo, la escasa disponibilidad en el mercado de catéteres compatibles con la RM, visibles por RM y que permitan administrar dichas inyecciones impide el uso extendido de estas técnicas.
TOMOGRAFÍA COMPUTARIZADA
La TC cardiaca se usa en la práctica clínica para obtener imágenes de las arterias coronarias y para detectar aneurismas y disecciones aórticas, embolias pulmonares y afección del pericardio. Básicamente, la TC cardiaca es un método radiográfico que proporciona rápidamente imágenes tridimensionales del corazón. A menudo se utiliza con medios de contraste yodados para ver más claramente los vasos sanguíneos. El escáner de TC consta de un anillo o soporte con un tubo de rayos X montado frente a un detector.
Durante la realización del estudio, el tubo y el detector giran alrededor del anillo. A medida que el tubo gira, emite rayos X que penetran y son absorbidos por el sujeto situado en el centro del escáner. El detector capta los rayos X no absorbidos.
A continuación, la señal detectada se procesa mediante algoritmos de reconstrucción avanzados para generar una imagen de TC tridimensional. Para la TC cardiaca puede utilizarse una señal de ECG de forma prospectiva para dar paso o iniciar la adquisición de la imagen, o bien para realizar una reconstrucción retrospectiva.
Al igual que en la RM, se validaron equipos de TC con multidetectores realzados con contraste para mejorar la definición de las imágenes48. Posteriormente, Amado et al27 usaron la TC cardiaca en combinación con las técnicas de RM antes descritas para estudiar la regeneración cardiaca tras el trasplante intramiocárdico de MSC en cerdos postinfarto.
En un estudio de 8 semanas de duración, la TC con contraste mostró un aumento del espesor del borde del tejido subendocárdico y una reducción del tejido cicatricial. Estos datos fueron respaldados por la presencia de una recuperación de la contractilidad activa en las regiones asociadas determinada mediante RM con marcadores. Por otra parte, la anatomía patológica confirmó que este borde de tejido contenía miocitos morfológicamente normales.
Recientemente se han explorado técnicas de microencapsulación en combinación con medios de contraste49,50 para obtener imágenes como método de inmunoprotección celular, al tiempo que proporcionan un entorno que permite el libre paso de oxígeno y nutrientes hacia las células y de los subproductos hacia el exterior de éstas. Utilizando medios de contraste radiopacos, Barnett et al49 marcaron y encapsularon células de islotes pancreáticos y demostraron capacidad de respuesta eficaz a la glucosa.
Los primeros estudios que utilizaron esta técnica con células madre mesenquimatosas51-55
resultaron prometedores, especialmente para aumentar la angiogénesis, como se demostró en un modelo de arteriopatía periférica en conejos. En la figura 3 se muestra un ejemplo de imágenes obtenidas mediante TC de dichas microcápsulas visibles con rayos X trasplantadas en un corazón ex vivo.
Fig. 3. Tomografía computarizada de un corazón extirpado tras el trasplante de células madre mesenquimatosas encapsuladas con sulfato de bario. Las múltiples inyecciones de las microcápsulas son claramente visibles a través del corazón.
IMÁGENES DE MEDICINA NUCLEAR
La medicina nuclear utiliza isótopos radiactivos para seguir los procesos biológicos y metabólicos celulares y subcelulares. En general, estos isótopos radiactivos o radionúclidos se encuentran unidos químicamente a complejos diseñados para detectar específicamente determinados procesos fisiológicos. Estos complejos radiactivos, denominados trazadores, se introducen en el cuerpo antes de obtener la imagen (a menudo mediante inyección intravenosa).
En función del diseño del trazador, el proceso patológico puede ser identificado por una captación elevada del trazador radiactivo o por su ausencia. Las dos técnicas de obtención de imagen más utilizadas en medicina nuclear topográfica son la PET y la SPECT.
Tomografía por emisión de positrones
La PET funciona según el siguiente principio: los trazadores emiten positrones que aniquilan los electrones cercanos, lo que da lugar a la emisión de dos fotones gamma (511 keV) en direcciones opuestas. La detección coincidente de dichas emisiones por múltiples detectores en el escáner de PET permite localizar directamente los fenómenos de aniquilación.
Para generar las imágenes tridimensionales de PET se emplean análisis estadísticos y una reconstrucción tomográfica. Los radionúclidos de la PET tienen una vida media corta (de unos 20 min para el 11C a unos 110 min para el 18F y hasta 4,2 días para el 124I), por lo que a menudo requieren la disponibilidad del ciclotrón que los produce en el mismo lugar o en un lugar próximo. Además, su corta semivida requiere que los trazadores alcancen su objetivo muy rápidamente.
La molécula trazadora de uso más frecuente es la fluorodesoxiglucosa (FDG), un azúcar marcado con el isótopo 18F utilizado para estudiar el metabolismo de la glucosa. En cardiología clínica, la PET con 18F-FDG se emplea muy a menudo para detectar el «miocardio hibernado» o tejido cardiaco viable pero con disminución de su función metabólica. Clínicamente, este miocardio hibernado se considera recuperable si en un corto plazo se logra la revascularización.
Aunque se haya utilizado ampliamente para obtener imágenes de viabilidad, la PET también permite determinar la perfusión, la función contráctil, el sustrato metabólico, el consumo de oxígeno, la inervación autonómica y la angiogénesis56. Por lo tanto, la imagen de PET puede tener un valioso papel en la evaluación exhaustiva de la respuesta terapéutica de los tratamientos celulares.
Quizá el punto más fuerte de la obtención de imágenes con PET en el contexto de la terapia celular es su capacidad para el rastreo celular. La marcación radiactiva de las células para obtener imágenes de PET puede realizarse directamente con radionúclidos o mediante un gen informador.
La marcación directa requiere incubar las células con el radiotrazador para lograr una captación celular suficiente. Recientemente, la 18F-FDG se ha utilizado con éxito para marcar y realizar el seguimiento de la distribución tisular de células mononucleares y células progenitoras de médula ósea autóloga tras el trasplante intracoronario en corazones de cerdo postinfarto57-59.
El éxito de la PET con marcación directa resulta muy prometedor, pero se encuentra limitado principalmente por la corta semivida del 18F. Hasta la fecha, se ha obtenido un éxito limitado con la marcación directa usando isótopos de semivida más prolongada. Por otra parte, al igual que en la marcación magnética, la detección de células madre marcadas directamente con radionúclidos se verá dificultada si hay una rápida proliferación celular.
Los recientes avances en la marcación celular con genes informadores amplían las posibilidades de las imágenes de PET más allá de la monitorización a corto plazo. Los genes informadores codifican la síntesis de sustancias tales como enzimas o receptores, que se unirán a una sonda informadora. Para la marcación, normalmente se introduce un gen informador en las células mediante transfección de forma exógena. Tras el trasplante, la obtención de una imagen de PET con una sonda informadora específica marcada con un radionúclido permite la detección de las células.
Para más información acerca de la marcación celular con genes informadores, se puede consultar Bengel et al60. Hasta la fecha, existen tres tipos de genes informadores, basados en enzimas, en receptores y en proteínas transportadoras.
Cada planteamiento posee diferentes ventajas e inconvenientes, como señalan Zhang et al61. Actualmente, la técnica más habitual de marcación celular con genes informadores para obtener imágenes de PET es la basada en enzimas que utiliza el gen mutante de la timidincinasa de virus del herpes simple tipo 1 (HSV1-tk) en combinación con diferentes radionúclidos trazadores con 18F.
Por ejemplo, Wu et al62 publicaron un estudio en el que usaron HSV1-sr39tk como gen informador para PET para realizar el seguimiento celular tras el trasplante intramiocárdico de cardiomioblastos de rata embrionaria. En ese estudio demostraron la supervivencia a largo plazo de las células a los 16 días. En un estudio posterior de Cao et al63 se desarrolló y se utilizó un nuevo gen informador de fusión triple para obtener imágenes de fluorescencia, bioluminiscencia y PET para estudiar la supervivencia celular, la proliferación y la migración de las células madre embrionarias tras su administración en miocardio de rata.
Las imágenes de PET obtenidas con 9-[4-18F-fluoro-3-(hidroximetil) butil]guanina (18F-FHBG) confirmaron la supervivencia y la proliferación indicada por un aumento de la señal de la PET (y por bioluminiscencia) durante las 4 semanas de duración del estudio. Las imágenes de fusión de 18F-FHBG (células marcadas) y 18F-FDG (viabilidad miocárdica) obtenidas en este estudio demuestran la localización celular mediante PET (fig. 4).
Fig. 4. Cartografía endocárdica de un corazón de cerdo 16 días tras infarto de miocardio. A: mapa de voltaje con los lugares (puntos negros) de las inyecciones intramiocárdicas guiadas NOGA (Cordis, Johnson & Johnson) de MSC transfectadas con HSV1-tk (flechas blancas en la zona fronteriza del infarto) y de MSC no transfectadas (flecha amarilla en la pared posterior no infartada).
La viabilidad normal se representa en azul y rosa. Los colores amarillo y verde representan una menor viabilidad en la pared mediodistal anterior y el rojo representa la inviabilidad en el ápex cardiaco. B: 13N amonio; PET con una imagen de transmisión de corazón de cerdo (en decúbito supino) 16 días después de un infarto agudo indicando un defecto de perfusión en la pared anterior y el ápex. C: captación del trazador 18F-FHBG en los dos puntos de inyección, representando la ubicación de las MSC transfectadas 8 h después de la administración de las células en el interior del miocardio (imagen de transmisión de PET, cerdo en decúbito supino). No se observa actividad en la pared posterior, donde no se inyectaron MSC transfectadas. D: imagen de fusión de RM (en escala de grises) y PET con 18FFHBG PET (escala de color) que indica la acumulación de trazador sólo donde se inyectó intramiocárdicamente un vector lentiviral para la expresión transgénica de la proteína de trifusión renilla luciferasa, proteína fluorescente roja y timidincinasa truncada de herpes simple (VI-RL-RFP-tTK-MSC). E: imagen híbrida de PET-TC con 18F-FHBG para localizar las células inyectadas en la pared anterior. F: ampliación de una región de interés de la TC con 18F-FHBG. Reproducido con autorización de Gyöngysi et al64. 18F-FHBG: 9-[4-18F-fluoro-3-(hidroximetil)butil] guanina; MSC: células madre mesenquimatosas; PET: tomografía por emisión de positrones; RM: resonancia magnética; TC: tomografía computarizada.
Recientemente se han usado genes informadores de PET en un estudio de gran envergadura en modelo animal de infarto miocárdico reperfundido para seguir la biodistribución tras la inyección miocárdica directa, usando un sistema de cartografía electromecánico64. Esos estudios se llevaron a cabo en un escáner de PET clínico con resultados prometedores que animan a la realización de estudios similares en pacientes en un futuro.
Tomografía computarizada por emisión de fotón único (SPECT)
A diferencia de las imágenes de PET, la SPECT opera detectando directamente la radiación gamma emitida por el trazador. Durante la adquisición de las imágenes mediante SPECT, la cámara gamma gira alrededor del sujeto obteniendo las imágenes proyectadas. Se usa una retroproyección filtrada y una reconstrucción iterativa para crear un volumen tridimensional de los datos proyectados en dos dimensiones. La sincronización de la imagen de SPECT con el electrocardiograma se usa normalmente para cuantificar la perfusión, el espesor y la contractilidad miocárdicos, así como otros parámetros de la función ventricular. La imagen de SPECT también puede utilizarse para evaluar la viabilidad, el sustrato metabólico y la muerte celular65, datos muy importantes a la hora de valorar la eficacia de la terapia celular y comprender los mecanismos por los que la terapia celular influye en el tratamiento de la enfermedad.
Al igual que en las imágenes de PET, la marcación de células para SPECT puede dividirse en técnicas de marcación directa y con genes informadores. La directa requiere la incubación de células con isótopos radiactivos como 111In-oxina; se ha demostrado que éste no afecta a la capacidad proliferativa de las células ni a los marcadores de superficie o intracelulares65. En general, los radiomarcadores para SPECT presentan diversas ventajas respecto a los trazadores de PET, como una semivida más larga, una mayor eficiencia de la marcación y una mayor estabilidad61. Las imágenes de SPECT se han utilizado para monitorizar y rastrear la distribución de la terapia con células marcadas directamente con radionúclidos66. En este estudio, las MSC se marcaron directamente con 111In (semivida de 67 h) y nanopartículas de óxido de hierro. Las células se administraron por vía intravenosa a perros 3 días después de provocar infartos de miocardio reperfundidos. Las imágenes de SPECT se obtuvieron de forma seriada hasta 8 días después de la inyección. Aunque la captación inicial tuvo lugar principalmente en los pulmones, con una redistribución significativa en el hígado, en varios de los animales infartados se observó una captación focal y difusa en el corazón (fig. 5), sin que se observara ninguna detección mediante imágenes de RM. Este estudio demuestra el valor de las imágenes de SPECT para seguir la biodistribución y el destino de las células tras su administración intravenosa, y además muestra mayor sensibilidad para visualizar las células marcadas en comparación con la RM.
Fig. 5. Representaciones de volumen fundido de tomografías por emisión de fotón único (rojo) con tomografías computarizadas (gris) de un perro inmediatamente (A), 24 h (B) y 5 días (C) después de la administración intravenosa de células madre mesenquimatosas de médula ósea marcadas con 111In-oxina. La captación inicial (A) tiene lugar predominantemente en los pulmones y se redistribuye hacia el bazo y el corazón a las 24 h (B). A los 5 días de su administración, las células permanecen visibles en el corazón y después se redistribuyen al hígado. Reproducido con autorización de Kraitchman et al52.
La marcación con genes informadores para SPECT se lleva a cabo de forma similar que para las imágenes PET, sustituyendo simplemente el sustrato marcado con un isótopo radiactivo emisor de fotón único67,68. Por ejemplo, Stodilka et al69 usaron MSC marcadas con 111In y con un gen informador introducido mediante transfección, que se continuó con la detección sistémica de una sonda informadora marcada con 131I para rastrear las células en un miocardio infartado de perro. Mediante una técnica de doble isótopo, pudieron corregir efectos físicos tales como intercomunicación, dispersión y atenuación, realizando posteriormente una evaluación cuantitativa de la expresión celular. En otro estudio, la proteína transportadora de yoduro de sodio (NIS) fue transducida al interior de células madre procedentes de tejido cardiaco usando vectores lentivirales, y se utilizaron 99mTC (SPECT) y 124I (PET) para detectar y localizar las células madre in vivo70.
Puesto que las imágenes de PET y SPECT no captan necesariamente la anatomía, a menudo se combinan con otras técnicas de obtención de imágenes como TC o RM para localizar mejor los resultados. Recientemente, la comunidad científica y las empresas han comenzado a integrar estas imágenes de medicina nuclear con las imágenes de TC y RM para obtener las imágenes de forma más precisa. Asimismo, las imágenes anatómicas pueden utilizarse para corregir la atenuación y proporcionar así una cuantificación más precisa de la actividad metabólica.
CONCLUSIONES
Las técnicas no invasivas de obtención de imágenes cardiovasculares tales como ecocardiografía, RM, TC, PET y SPECT resultan de un valor inestimable en la investigación básica. Al presentar su potencial en el contexto de su aplicación a las terapias celulares, esta revisión no ha pretendido profundizar en el conjunto de todas sus posibilidades, aunque podría servir de marco para comenzar a entender su importancia. Por otra parte, hay que destacar que ya existen o se vislumbran muchas otras técnicas no invasivas que prometen seguir impulsando la utilidad de las técnicas de imagen en la investigación básica71.


No hay comentarios:
Publicar un comentario